Diagnóstico del laboratorio de la anemia por deficiencia de hierro: herramientas y desafíos

El diagnóstico de laboratorio de la anemia por deficiencia de hierro es complejo debido a la homeostasis del hierro. No existe una sola prueba específica, por lo que se requiere la evaluación de múltiples parámetros hematológicos y bioquímicos.
¿Qué causa deficiencia de hierro?
Las demandas fisiológicas aumentadas, como el crecimiento, la menstruación, el embarazo y la lactancia, generan mayores necesidades de hierro. La pérdida de sangre, ya sea por vías gastrointestinal o urogenital, así como por procedimientos médicos, también puede contribuir a la deficiencia de hierro. La mala absorción de hierro puede ser causada por condiciones como resecciones gástricas, gastritis crónica atrófica y el uso de ciertos medicamentos. Por último, los ancianos y las personas que siguen una dieta vegetariana pueden tener una ingesta inadecuada de hierro, especialmente aquellos que no incluyen vegetales ricos en hierro en su dieta.
¿Qué métodos de diagnóstico se usan en el laboratorio para detectar la anemia por deficiencia de hierro?
El diagnóstico de la anemia ferropénica en el laboratorio es difícil debido a la dinámica homeostasis que presenta el hierro. Ninguna prueba por sí sola proporciona una evaluación precisa de la absorción, el transporte, el almacenamiento y la utilización del hierro, por ello las pruebas de laboratorio deben realizarse en el contexto de una anamnesis y un examen clínico detallado.
El hemograma evalúa la anemia a través del número de glóbulos rojos y de la hemoglobina (Hb), pero estos no indican el estado del hierro. Los parámetros eritrocitarios del hemograma, como el volumen corpuscular medio (VCM), hemoglobina corpuscular media (HCM), concentración de hemoglobina corpuscular media (CHCM) y amplitud de distribución eritrocitaria (ADE), reflejan de manera indirecta el estado del hierro (microcitosis, hipocromía y anisocitosis respectivamente), aunque estas alteraciones no son patognomónicas de ferropenia y pueden observarse en otras patologías como la talasemia. Además, hay que tener en cuenta que el parámetro VCM está influenciado por condiciones preanalíticas como la temperatura y el tiempo de almacenamiento de la muestra. Los reticulocitos se encuentran normalmente disminuidos.
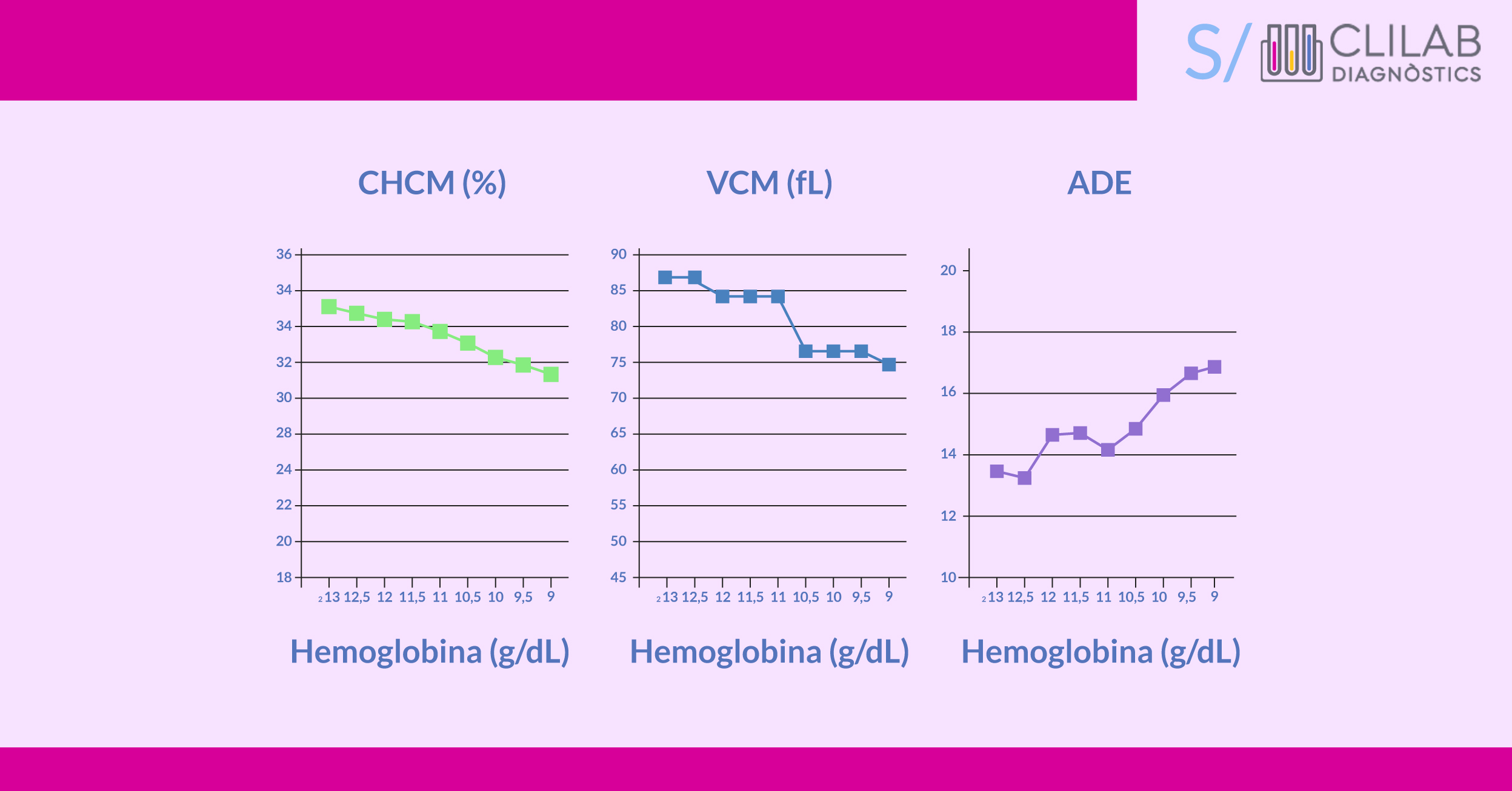
Figura 1. Evolución de la CHCM, VCM y ADE en un caso de anemia ferropénica. Failace. R hemograma manual de interpretação (5ªed) Porto alegre Armed 2011
Índices hematológicos avanzados
Se utilizan, junto a parámetros bioquímicos, para diferenciar entre anemia ferropénica y anemia de trastornos crónicos y monitorizar la respuesta al tratamiento con hierro. Su uso está indicado en guías de práctica clínica.
Los hematíes hipocrómicos son hematíes con una concentración de hemoglobina celular <29g/dL. Este parámetro refleja la hemoglobinización de los hematíes en los 3-4 meses anteriores. Un valor >=6% indicaría déficit de hierro.
El contenido de hemoglobina reticulocitaria corresponde a la medida del contenido de hemoglobina de los reticulocitos y refleja la disponibilidad del hierro de manera efectiva para la hemoglobinización de los hematíes en los 3-4 días siguientes, tiempo de vida media de los reticulocitos en sangre periférica. Una concentración de Hb-Ret <29g/dL se considera buen indicador de déficit de hierro en la población general. Hay que tener en cuenta que otras situaciones clínicas pueden afectar sus valores.
Citología en sangre periférica
Los cambios morfológicos en los glóbulos rojos pueden orientar hacia la anemia ferropénica, aunque en la mayoría de los casos suelen confirmar los resultados hematimétricos y bioquímicos. La anemia ferropénica de instauración reciente es normocítica y normocroma. Al progresar la carencia, la anemia se vuelve hipocrómica y posteriormente microcítica. En las fases avanzadas, se observan alteraciones morfológicas eritrocitarias, como anisocitosis y poiquilocitosis con presencia de eliptocitos y punteado basófilo fino. Además, es frecuente observar un elevado número de plaquetas y, en algunos casos, los leucocitos presentan núcleos hipersegmentados.
Aun no siendo el método de diagnóstico definitivo, la revisión del frotis de sangre periférica ayuda a identificar alteraciones específicas y sugerir otros diagnósticos en casos de incertidumbre.
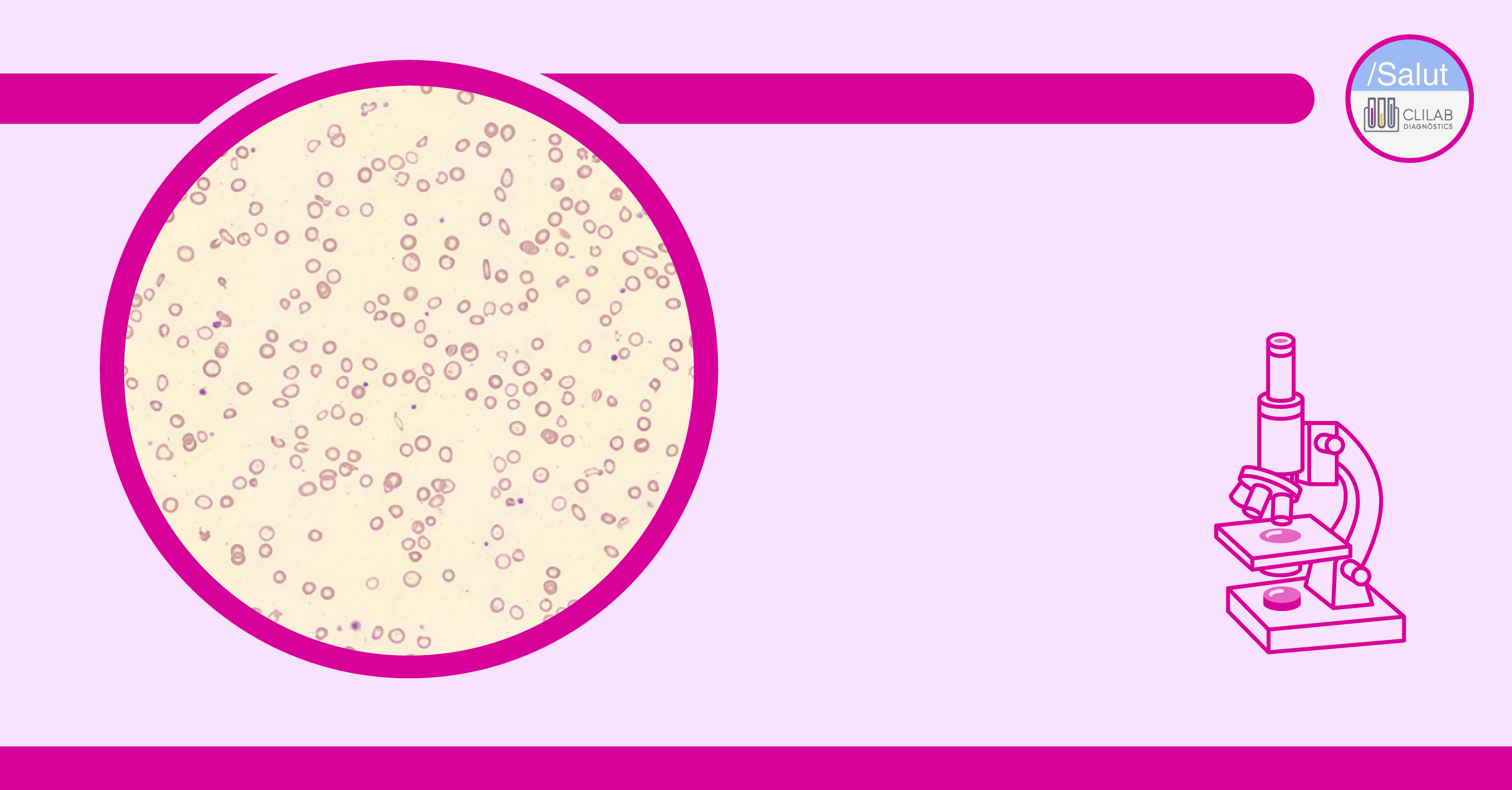
Figura 2. Frotis de sangre periférica que muestra anisocitosis, hipocromía y eliptocitos.
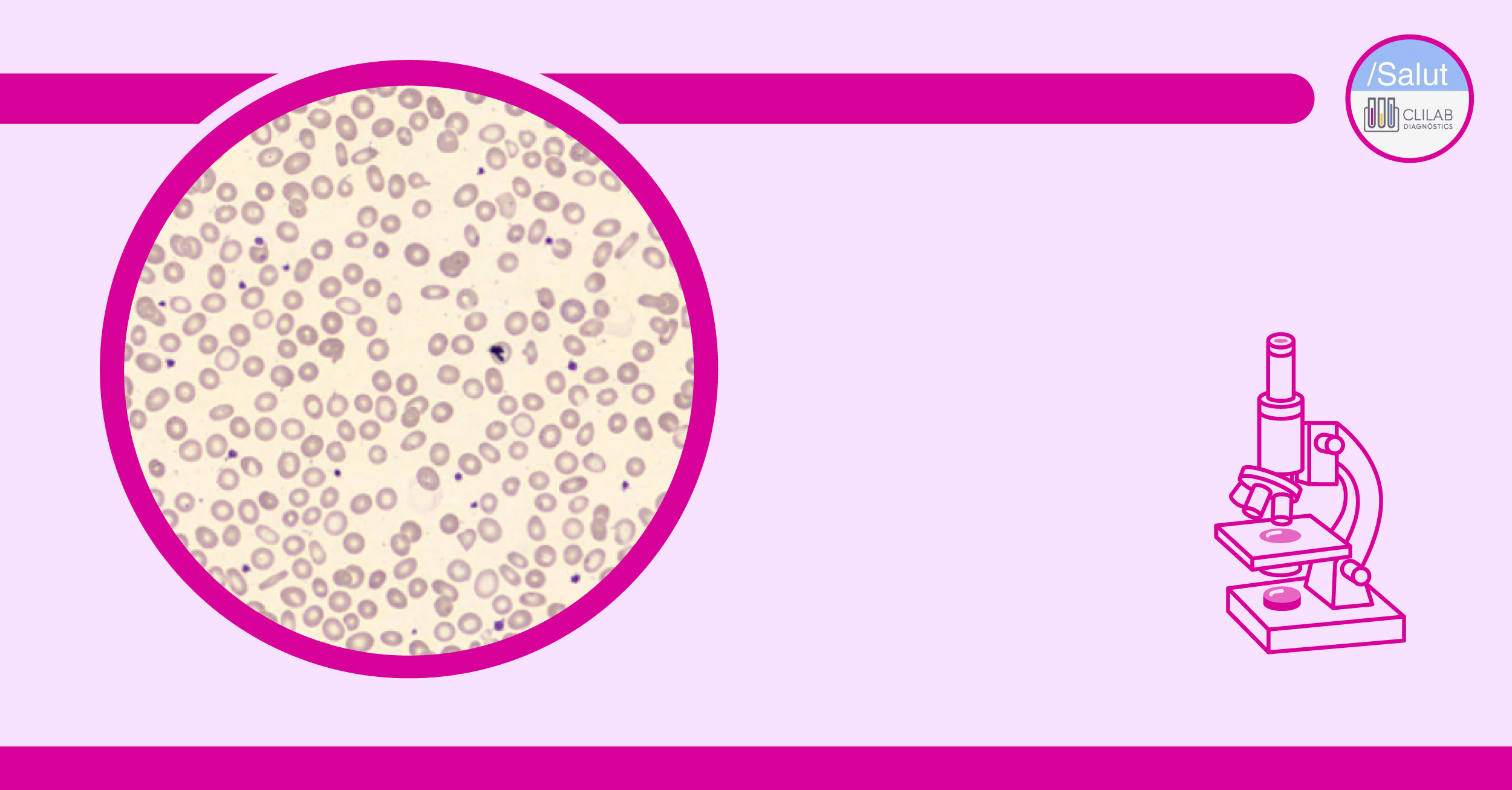
Figura 3. Frotis de sangre periférica que muestra anisocitosis con microcitosis, hipocromía y eliptocitos.
El hierro sérico mide la cantidad de hierro oxidado (Fe3+) en la circulación sanguínea, unido a la transferrina. Una deficiencia de hierro generalmente se refleja en una concentración baja de hierro sérico, aunque este valor muestra una elevada variación intraindividual, y por eso, aporta información limitada sobre el metabolismo férrico. Debido a esto, el hierro sérico se interpreta junto con otras pruebas como la ferritina, transferrina y la capacidad total de fijación de hierro.
La ferritina es la principal forma de almacenamiento tisular de hierro en el interior de las células. Una pequeña proporción pasa al plasma y es la que puede cuantificarse con precisión mediante inmunoensayo.
La ferritina sérica es un reactante de fase aguda, lo que significa que los niveles aumentan en respuesta a estados inflamatorios y enfermedades sistémicas, dificultando su interpretación clínica. Se han propuesto diferentes puntos de corte para interpretar la ferritina en el contexto de marcadores inflamatorios elevados, como la proteína C reactiva (PCR) o la velocidad de sedimentación globular (VSG).
En ausencia de inflamación o enfermedad sistémica, la concentración plasmática de ferritina se correlaciona con los depósitos de hierro del organismo: 1 µg /L de ferritina sérica corresponde a 8-10mg de hierro almacenado en un adulto sano.
Existe disparidad en los valores discriminantes recomendados por las guías de práctica clínica para indicar ausencia de reservas de hierro. El punto de corte más utilizado en adultos y en menores de 5 años, en ausencia de ferropenia, es de 15 µg/l y 12 µg/l respectivamente, el cual indicaría con alta probabilidad deficiencia de hierro. Valores entre 15-100 µg/l en presencia de inflamación crónica no excluyen ferropenia, por lo que se recomiendan determinaciones adicionales como el receptor soluble de la transferrina o la hemoglobina reticulocitaria.
Las indicaciones para la medida de la concentración de ferritina son la detección de la deficiencia de hierro y la monitorización del tratamiento.
La concentración de transferrina, la proteína plasmática predominante en el transporte de hierro, puede medirse mediante un ensayo inmunoturbidimétrico directo. Su valor aumenta en la carencia de hierro. La transferrina es un reactante de fase aguda negativo, por lo que disminuye en caso de inflamación y, también, en enfermedades crónicas que disminuyen su síntesis.
Capacidad total de unión al hierro (CTFH o TIBC)
La capacidad total de unión al hierro (CTFH o TIBC) mide la cantidad de hierro que puede ser fijado por las proteínas en la sangre. Se calcula añadiendo un exceso de hierro al suero, eliminando el hierro no unido y midiendo la concentración de hierro en la muestra restante. Es una medida indirecta de la transferrina, por lo que se encuentra elevada en deficiencia de hierro. La TIBC y la transferrina presentan menos variabilidad que el hierro sérico, aunque su especificidad sigue siendo escasa
Capacidad libre de transporte de hierro (UIBC)
La capacidad libre de transporte de hierro (UIBC) determina la capacidad de reserva de transferrina para unir hierro. Puede medirse o calcularse mediante la fórmula: UIBC: TIBC – hierro.
Índice de saturación de transferrina (IST o TSAT)
El índice de saturación de transferrina (IST o TSAT) es el porcentaje que representa la relación entre el hierro sérico y la transferrina, reflejando la proporción de sitios de unión de la transferrina ocupados por moléculas de hierro. Depende de la concentración de hierro sérico y transferrina, por lo que conlleva una variabilidad similar. Un IST <16% puede respaldar el diagnóstico de anemia ferropénica cuando la ferritina sérica no es concluyente.

Figura 4. Comportamiento de los principales indicadores evaluados en la anemia ferropénica.
Receptor soluble de transferrina (sTfR)
El receptor soluble de transferrina (sTfR) es una proteína transmembrana que aumenta en ausencia de hierro. Se trata de una buena una alternativa al resto de parámetros bioquímicos, ya que su concentración no se altera por inflamación, por lo que es de gran utilidad para la detección del déficit funcional de hierro, aunque no es específico y también incrementa en otros trastornos eritroides. Su especificidad aumenta utilizando el índice de ferritina (sTfR/log ferritina) comparado con medidas aisladas del receptor soluble de la transferrina y la ferritina. Puesto que se trata de una prueba costosa y no estandarizada, se desaconseja su determinación en la valoración de casos con déficit de hierro simple.
Protoporfirina de zinc
La protoporfirina de zinc (ZPP) se produce como subproducto durante la síntesis del grupo hemo. En condiciones de deficiencia de hierro, se produce una acumulación de protoporfirina de zinc en los glóbulos rojos, ya que el el zinc se absorbe en lugar del hierro, lo que resulta en un aumento de los niveles de ZPP en sangre. Por lo tanto, un aumento de la ZPP suele ser indicativo de una anemia ferropénica. Su evaluación tiene limitaciones y carece de especificidad en anemias multifactoriales.
Hepcidina
La hepcidina, una proteína producida en el hígado que regula los niveles de hierro, disminuye a medida que los niveles de hierro bajan. Para su medición, se utilizan técnicas como espectrometría de masas o radioinmunoanálisis, aunque se espera que los ensayos inmunoenzimáticos (ELISA) tengan un futuro prometedor en el diagnóstico clínico.
Hierro medular
El estudio de la hemosiderina mediante la reacción del PerIs, es el gold estándar, junto con la valoración del número y características de sideroblastos y del hierro de depósito en los macrófagos.

Figura 5. Resumen de las recomendaciones para el diagnóstico de la anemia ferropénica en el laboratorio clínico.
¿Por qué es crucial detectar tempranamente la anemia por deficiencia de hierro?
La detección temprana de la anemia por deficiencia de hierro es crucial debido a su alta prevalencia y las graves consecuencias para la salud. El abordaje de esta condición puede evitar complicaciones como la disminución del rendimiento cognitivo, la debilidad muscular, la fatiga crónica y los problemas cardiovasculares. Además, permite implementar estrategias efectivas que mejoran la calidad de vida. Su diagnóstico desde el laboratorio constituye un reto, ya que no hay un único marcador específico.
REFERENCIAS
- Good Practice Paper for the laboratory diagnosis of iron deficiency in adults (excluding pregnancy) and children. BSH. https://b-s-h.org.uk/guidelines/guidelines/good-practice-paper-for-the-laboratory-diagnosis-of-iron-deficiency-in-adults-excluding-pregnancy-and-children
- Pérez Surribas D, Gella Concustell A, Cruz Iglesias E, et al. Estudio de la ferropenia en el laboratorio clínico. Revista del laboratorio clínico. 2019;12(4):34-53.
- Anemia. www.who.int. https://www.who.int/es/health-topics/anaemia#tab=tab_1
