Revisió de la fisiopatologia, diagnòstic i seguiment de les últimes actualitzacions de la Malaltia Celíaca
Revisió de la fisiopatologia, diagnòstic i seguiment de les últimes actualitzacions de la Malaltia Celíaca.
Un document elaborat per la Comissió d’Immunologia de CLILAB.
La celiaquia o malaltia celíaca (MC) és una malaltia inflamatòria crònica d’origen autoimmune que afecta la mucosa de l’intestí prim i que és desencadenada pel consum de gluten en persones genèticament predisposades, causant atròfia de les vellositats intestinals, increment del nombre de limfòcits intraepitelials i hiperplàsia de les criptes de l’intestí prim. La MC és més freqüent en dones que en homes (ratio 2:1) i té una prevalença mundial al voltant de l’1%.
Tot i que s’han descrit manifestacions extraintestinals, les manifestacions clàssiques afecten a l’intestí, fins al punt que actualment es considera la principal causa de malabsorció, i per això és important un diagnòstic precoç.
2. Fisiopatologia de la malaltia celíaca
El gluten està format per un conjunt de proteïnes presents a les llavors de molts cereals com el blat, sègol, ordi, algunes varietats de civada o en qualsevol de les seves varietats o híbrids, com l'espelta, escanda o kamut. No es troba al blat de moro ni a l'arròs.
- Prolamines: que segons el seu origen es classifiquen en gliadines (blat), secalines (sègol), hordeïnes (ordi) i avenines (civada), i són riques en aminoàcids com la glutamina i la prolina.
- Glutel·lines: anomenades glutenines quan procedeixen del blat.
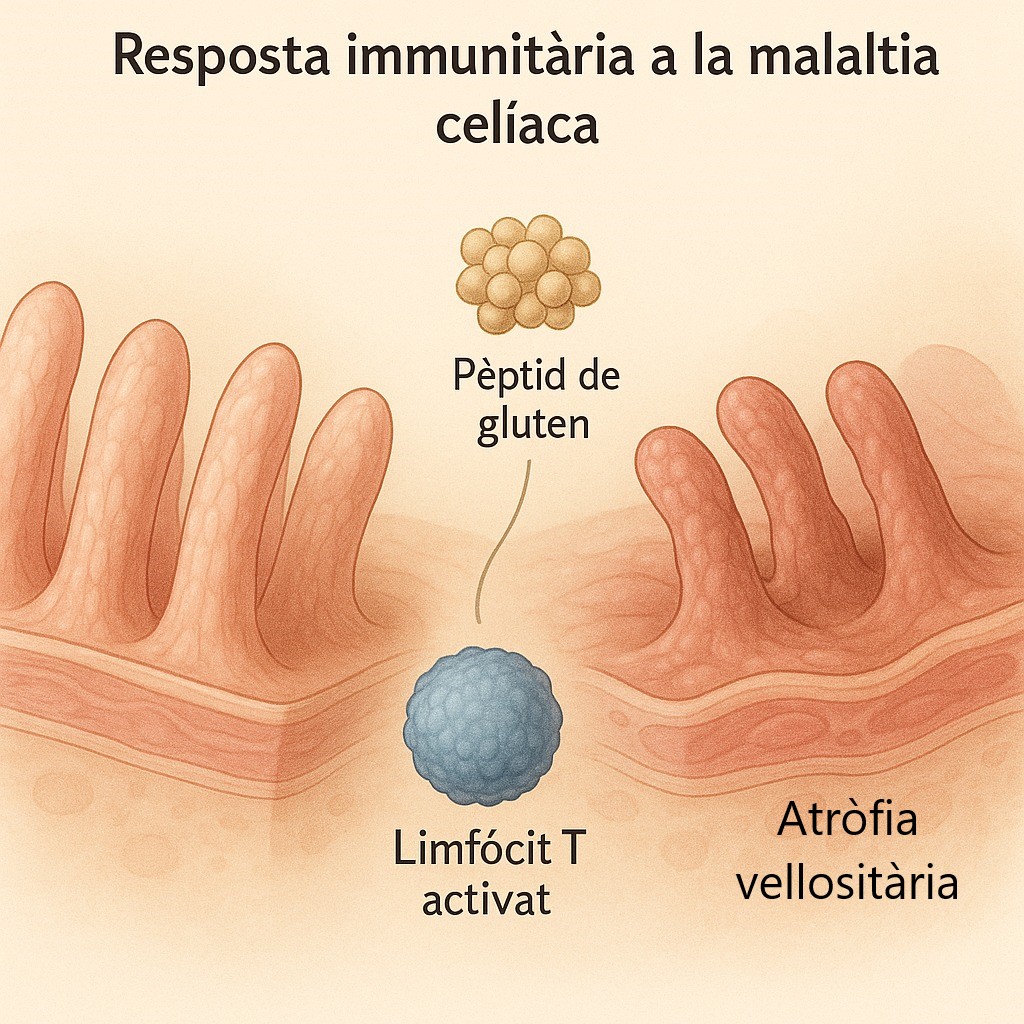
Els residus de prolina de les gliadines impedeixen la seva degradació proteolítica durant el seu pas pel pàncrees, de manera que aquestes gliadines arriben a la làmina pròpia de l’intestí intactes on són deamidades per l’enzim transglutaminasa tissular. Aquest procés de deamidació modifica les gliadines generant els pèptids deamidats de gliadina, que tenen càrrega negativa la qual facilita la unió a les molècules d’HLA DQ2 o DQ8 que s’expressen a les cèl·lules presentadores d’antigen de la làmina pròpia i que s’encarreguen de presentar aquests pèptids als limfòcits T CD4. A més, la interacció entre les gliadines i la transglutaminasa tissular durant el procés de deamidació produeix la unió covalent entre elles, generant complexes de mida més gran que també s’uneixen a les molècules d’HLA DQ2 o DQ8. Per tant, les molècules d’HLA DQ2 o DQ8 poden presentar als limfòcits T CD4 els pèptids deamidats de gliadina, els complexes gliadina-transglutaminasa i en alguns casos neoantígens generats de la formació d’aquests complexes. La presentació de qualsevol d’aquests antígens als limfòcits T CD4 produeix la seva activació, la qual genera un ambient proinflamatori amb la producció de citoquines com IFN-ɣ i IL-21, que indueixen tant la resposta cel·lular Th1 com la Th2, així com també la resposta humoral activant els limfòcits B que seran els productors dels autoanticossos dirigits contra els pèptids presentats per les molècules d’HLA DQ2 i DQ8.
Hi ha alguns pèptids de gliadina que no son reconeguts pels limfòcits T, però que interaccionen directament sobre l’epiteli intestinal mitjançant l'activació de mecanismes de la immunitat innata com la producció d'IL-15, que indueix l'apoptosi dels enteròcits alterant la funció de barrera epitelial i produint un augment de la permeabilitat a través de l'activació i la proliferació de limfòcits intraepitelials (LIEs) CD8+ que expressen receptors de cèl·lules Natural Killer (NK), expressades pels enteròcits en situacions d'estrès. La figura 1 resumeix els principals processos patogènics implicats en el desenvolupament de la MC.
En conjunt, genera un ambient altament inflamatori a la llum intestinal que provoca una alteració de la permeabilitat i l’absorció de nutrients que dona lloc a les manifestacions intestinals clàssiques.
3. Manifestacions clíniques
En funció de l’edat de presentació i les manifestacions clíniques, es diferencia entre:
- Clàssiques/típiques (6–18 mesos): generalment apareixen entre els 6 i 18 mesos d’edat, i es caracteritzen per simptomatologia intestinal a conseqüència de l’alteració de la permeabilitat intestinal i la malabsorció de nutrients causant pèrdua de pes, diarrea (amb presència o no d’esteatorrea) i retard en el creixement.
- No clàssiques/atípiques (adults): generalment apareixen a l’edat adulta i els símptomes poden ser força variables, des d'afectació intestinal (dolor abdominal, restrenyiment, inflor, síndrome de l’intestí irritable) fins a afectació extraintestinal (manifestacions neurològiques, fatiga, irritabilitat, anèmia ferropènica, dermatitis herpetiforme, osteoporosi, vòmits, infertilitat, avortaments de repetició, etc).
- Formes silents: en les quals hi ha alteració de la histologia intestinal i es detecten autoanticossos.
- Formes potencials: en les quals no es detecten autoanticossos, ni hi ha alteració de la histologia de l’intestí. Només es detecta una predisposició genètica.
A més, entre un 1-1.5% dels pacients diagnosticats de MC, poden desenvolupar formes refractàries de MC, les quals es caracteritzen per la presència de símptomes (malabsorció i pèrdua de pes), així com persistència de l’atròfia de les vellositats intestinals després d’un any amb dieta estricte sense gluten. Les formes refractàries es poden dividir en dos subtipus en funció de la presència, o no, de subpoblacions aberrants dels limfòcits intraepitelials: subtipus 1, en el qual no s’han descrit subpoblacions aberrants; i subtipus 2, en el qual les subpoblacions aberrants representen un 20% del total dels limfòcits intraepitelials, i s’associa a complicacions que poden ser greus com el limfoma de cèl·lules T associat a enteropatia.
4. Marcadors utilitzats pel diagnòstic
La realització d’una biòpsia intestinal ha estat el mètode de confirmació pel diagnòstic de la Malaltia Celíaca des del 1950. Tradicionalment, es requeria la realització de tres biòpsies: una biòpsia seguint una dieta amb gluten; una segona biòpsia després d’un període de dieta sense gluten; i una tercera biòpsia després d’una prova de provocació amb gluten per demostrar empitjorament amb la seva ingesta. És l’any 1990 quan l’ESPGAN (European Society of Paediatric Gastroenterology and Nutrition) publica els primers criteris diagnòstics de la Malaltia Celíaca basats en l’avaluació histològica d’aquestes tres biòpsies. Estudis posteriors van demostrar que la realització d’una única biòpsia intestinal al moment del diagnòstic era suficient en el 95% dels casos. Per l’avaluació histològica de la biòpsia es recomana la presa de diversos fragments de l’intestí (1-2 fragments del bulb, i 4 fragments del duodè distal) i s’utilitza la classificació de MARSH la qual en funció del grau d’atròfia de les vellositats intestinals i de la infiltració limfocitària, permet classificar l’estadi de la malaltia (Imatge 1).
Posteriorment, van aparèixer marcadors serològics (anticossos) amb bons valors de sensibilitat i especificitat que han portat a l’actualitat a plantejar, en les últimes guies, un algoritme diagnòstic sense la realització d’una biòpsia. Aquests anticossos són d’isotip IgA, excepte en els casos de pacients amb dèficit d’IgA (Immunodeficiència Primària més freqüent) que són d’isotip IgG. Els anticossos descrits van dirigits contra la isoforma tipus 2 de l’enzim transglutaminasa tissular que es troba a la paret prima dels músculs i a la mucosa de l’intestí prim; i també contra els pèptids deamidats de gliadina, els quals presenten una major sensibilitat en nens menors de 12 anys. A més, dins l’algoritme sense biòpsia proposat a les últimes guies (veure apartat 5), s’han inclòs els anticossos dirigits contra l’endomisi. L’endomisi és un teixit connectiu que es troba formant una baina que cobreix els músculs en la qual també hi és present l’enzim transglutaminasa tissular.
En la formació d’aquests anticossos hi intervé la predisposició genètica descrita i que es relaciona amb uns genotips concrets dels al·lels HLA (ja mencionats a l’apartat 2). Els al·lels HLA són molècules que s’expressen a la superfície de les cèl·lules nucleades del nostre organisme, i que participen en la resposta immunològica. La seva funció és la presentació dels antígens exògens (o autoantígens en el cas de les malalties autoimmunes) als limfòcits T induint tant la resposta cel·lular, com la resposta humoral amb la formació d’anticossos. Els genotips que s’han descrit de susceptibilitat a desenvolupar la MC són: HLA-DQ2.5, HLA-DQ2.2, HLA-DQ7.5 i HLA-DQ8. Tot i així, la presència d’un d’aquests genotips HLA no és diagnòstic ja que aquests estan presents en un 35-40% de la població general, i d’aquests, només un 1% acaba desenvolupant la MC.
Quan ni la histologia de la biòpsia (MARSH 0-1) ni els anticossos comentats són concloents, recentment ha agafat importància l’estudi de l’immunofenotip dels Limfòcits IntraEpitelials (LIEs) en la biòpsia mitjançant citometria de flux. Aquest estudi té una sensibilitat d’aproximadament un 92% i una especificitat del 93% del diagnòstic de Malaltia Celíaca. S’ha descrit que els pacients amb Malaltia Celíaca presenten un increment del nombre absolut de LIEs, un increment del percentatge de la subpoblació CD3+TCRƔδ+, i una disminució de la subpoblació CD3-CD103+.
5. Revisió de les guies diagnòstiques
Existeixen diverses guies pel diagnòstic i seguiment de la Malaltia Celíaca. La guia del col·legi americà de gastroenterologia ha estat la última actualització publicada l’any 2023. Tant aquesta última actualització, com la guia de la societat europea de d’estudi de la MC, com l’ESPGHAN (European Society Paediatric Gastroenterology, Hepatology and Nutrition), no contemplen un cribratge universal, sinó que es recomana una cerca activa en pacients amb símptomes o en familiars de primer grau de pacients diagnosticats. Les tres guies també coincideixen que l’estudi de sospita de MC s’ha de realitzar quan el pacient està seguint una dieta amb gluten.
Pel diagnòstic de MC, les tres guies coincideixen en iniciar l’estudi amb el diagnòstic serològic amb la determinació dels anticossos anti-transglutaminasa IgA, juntament amb els nivells totals d’IgA per diagnosticar els dèficits d’IgA (afecta entre un 2 i un 3% dels pacients amb MC). En els casos de dèficit d’IgA, s’haurà de realitzar l’estudi serològic d’isotip IgG. En pacients adults amb anticossos anti-transglutaminasa IgA positius, les tres guies coincideixen en que el diagnòstic probable de MC s’ha de confirmar amb la realització d’una endoscòpia amb la presa de múltiples biòpsies duodenals de diversos fragments del bulb i del duodè distal, tal i com s’ha indicat a l’apartat 4. L’ESPGHAN defineix un protocol diagnòstic en nens sense la necessitat de realitzar una endoscòpia, el qual també comparteix l’última actualització del col·legi americà de gastroenterologia pels adults amb condicions fisiològiques que impedeixin la realització de l’endoscòpia, o que no vulguin per pròpia voluntat. En aquests casos, si els pacients (nens i adults concrets mencionats) presenten anticossos positius amb nivells superiors a 10 vegades el límit de normalitat, aquests s’han de confirmar amb una segona mostra de sang, juntament amb la determinació dels anticossos anti-endomisi. La confirmació dels nivells d’anticossos anti-transglutaminasa i la positivitat dels anticossos anti-endomisi IgA en la segona mostra de sang, permet classificar els adults amb un diagnòstic probable de MC, i als nens diagnosticar-los de MC. Referent a l’estudi genètic (HLA-DQ2/DQ8), les tres guies coincideixen en l’elevat valor predictiu negatiu, pel qual recomanen realitzar-lo en pacients que han iniciat la dieta sense gluten abans de fer-se l’estudi serològic, o en pacients amb estudi serològic negatiu però estudi histopatològic suggestiu de MC, o bé en pacients amb clínica però estudi serològic i histopatològic negatiu, en els quals un resultat negatiu permetrà pràcticament excloure el diagnòstic de MC.
6. Realització del seguiment de la MC
El tractament de la MC és la Dieta Sense Gluten (DSG). És important realitzar educació sanitària al pacient sobre la importància de realitzar una correcta adherència a la DSG per evitar dèficits nutricionals secundaris, assegurar un correcte creixement i desenvolupament en el cas dels nens/es i aconseguir una restauració completa de la mucosa de l’intestí. Tant l’ESPHGAN (per nens i adolescents) com la guia del col·legi americà de gastroenterologia (per adults) coincideixen en el següent protocol de seguiment una vegada fet el diagnòstic de MC:
- Primera visita als 3-6 mesos del diagnòstic, que inclogui:
- Avaluació clínica amb la presència de símptomes gastrointestinals o extraintestinals
- Paràmetres antropomètrics i de creixement en el cas de la població pediàtrica
- Determinació dels anticossos anti-transglutaminasa IgA (o IgG en cas de dèficit) com a marcador de curació de la mucosa intestinal i de seguiment de la DSG
- Determinacions bioquímiques per detectar possibles dèficits nutricionals i malalties associades a la MC: hemoglobina, ferro, vitamina B12, vitamina D, metabolisme hepàtic (ALT), TSH, T4, anti-TPO, anti-TSH i anti-tiroglobulina.
L’avaluació histològica de l’intestí mitjançant biòpsia és l’única manera que permet confirmar la restauració completa de la mucosa intestinal després d’iniciar la dieta sense gluten i avaluar-ne així una correcte adherència. Tot i així, la restauració completa és lenta (aproximadament 3 anys des de l’inici de la DSG) i en un cert nombre de pacients no es produeix tot i l’estabilitat clínica i la negativitat dels anticossos anti-transglutaminasa IgA. La no restauració completa de la mucosa intestinal pot conduir al desenvolupament d’una MC refractària i és per això, que en adults les guies recomanen realitzar una biòpsia de seguiment al cap de 2 anys d’haver iniciat la DSG encara que els anticossos siguin negatius sobretot en pacients amb persistència de simptomatologia o en pacients amb un grau elevat d’atrofia vellositària a la biòpsia del diagnòstic. En nens i adolescents, al ser una prova invasiva, no està indicada la realització d’una biòpsia de seguiment, només en casos concrets (dubtes en el diagnòstic inicial o sospita d’una patologia digestiva concomitant). En aquest context, ha agafat força la determinació dels pèptids immunogènics del gluten (GIP). És cert que l’ESPHGAN refereix encara la manca de més dades per tal d’establir unes recomanacions sobre la seva utilitat per avaluar l’adherència de la DSG, però en aquest context, la Societat Espanyola de Malaltia Celíaca (SEEC) va publicar l’any passat un protocol (Evaluación de la adherencia a la dieta sin gluten en pacientes adolescentes y adultos con enfermedad celiaca: estrategia de manejo de los péptidos inmunogénicos del gluten) sobre la utilitat de la determinació dels GIP en pacients adolescents (majors de 14 anys) i pacients adults diagnosticats de MC en la valoració de l’adherència a la DSG. Els GIP són els fragments del gluten resistents a la digestió gastrointestinal i els principals responsables de la resposta immunitària en els pacients celíacs. La recuperació de GIP en femta o orina indica que hi ha hagut consum de gluten d’una manera no invasiva com seria la biòpsia. En aquest context, existeixen diversos estudis que demostren la correlació entre la presència d’atròfia de les vellositats intestinals en la biòpsia, i la detecció de GIP en femta o en orina. És per això que el protocol proposat per la SEEC proposa la determinació semestral de GIP en aquells pacients ben diagnosticats. En cas d’una o més determinacions de GIP positiva durant el seguiment permetrà predir la possibilitat de persistència de lesions histològiques, i en aquells pacients amb simptomatologia persistent discernir entre una mala adherència a la DSG o a la coexistència d’altres entitats clíniques. Per l’avaluació semestral de GIP en femta es recomana la determinació de dues mostres/setmana dos o tres dies abans de la revisió; i pel que fa a la determinació en orina es recomana la determinació de tres mostres/setmana i recollir-les amb la primera orina del dia.
7. Punts clau
- Els anticossos dirigits contra la transglutaminasa són els principals anticossos relacionats amb la MC, i s’utilitzen principalment en el seguiment a l’inici del diagnòstic i de la DSG. A CLILAB utilitzem la tècnica de quimioluminiscència (CLIA) que presenta una elevada sensibilitat i especificitat.
- Per una correcte valoració dels anticossos anti-transglutaminasa és important haver descartat prèviament un dèficit d’IgA, així com mantenir el gluten a la dieta fins al diagnòstic definitiu.
- A CLILAB som coneixedors de les últimes guies de l’ESPGAN, i per això disposem de la determinació dels anticossos anti-endomisi, els quals s’amplien des del laboratori seguint l’algoritme proposat a les guies.
- Recentment, a CLILAB hem incorporat l’immunofenotip dels LIEs en biòpsia duodenal mitjançant citometria de flux, el qual permet confirmar i/o descartar el diagnòstic en casos dubtosos.
- L’últim protocol de la Societat Espanyola de la Malaltia Celíaca (SEEC), agafa una rellevància important en el seguiment de les transgressions dietètiques difícils de controlar, la determinació dels pèptids immunogènics del gluten en femta i en orina. A CLILAB som coneixedors de la utilitat d’aquesta determinació, i per això recentment l’hem incorporat al nostre catàleg.
Bibliografia
- Am J Gastroenterol 2023;118:59–76: American College of gastroeneterology Guidelines Update: Diagnosis and Management of Celiac Disease
- JPGN • Volume 75, Number 3, September 2022: ESPGHAN Position Paper on Management and Follow up of Children and Adolescents with celiac disease
- Sociedad Española de Enfermedad Celíaca: Evaluación de la adherencia a la dieta sin gluten en pacientes adolescents y adultos con enfermedad celíaca: estrategia de manejo de los péptidos inmunogénicos del gluten
- Novedades en el diagnóstico de la enfermedad celíaca. Pérez Torrella, D., Paniagua Arribas, E.; For Cont Lab Clin 2024;7;1-29
- Foods 2025, 14, 959: Celiac Disease—Narrative Review on Progress in Celiac Disease
