Next Generation Sequencing (NGS) en la práctica clínica

Bases de la Secuenciación Masiva
La secuenciación masiva (también conocida como Next Generation Sequencing o NGS) se ha convertido en una herramienta revolucionaria en el diagnóstico clínico.
La capacidad de analizar simultáneamente miles o millones de secuencias de ADN ha revolucionado la práctica clínica. La NGS facilita diagnósticos más precisos y tratamientos mejor adaptados a las necesidades individuales de los pacientes. Por ello, se ha convertido en el pilar fundamental de la medicina personalizada.
En lugar de aplicar un enfoque uniforme, la medicina personalizada nos abre la puerta a intervenciones más eficaces y con menos efectos secundarios. Exploremos las aplicaciones actuales de la NGS en el diagnóstico clínico y las perspectivas futuras orientadas a mejorar la calidad de vida y los resultados clínicos.
La revolución de la NGS en el diagnóstico clínico
El método de secuenciación tradicional, conocido como secuenciación Sanger, permite analizar una sola secuencia corta de ADN. A diferencia de este, la NGS permite la secuenciación de millones de fragmentos de ADN de forma paralela. Esto permite analizar, en una única prueba, varios paneles de genes o incluso genomas completos.
Antes, la estrategia para estudiar una enfermedad genética era el análisis secuencial de los genes candidatos conocidos. Es decir, un barrido, uno por uno, de los genes hasta detectar, o no, la mutación responsable del fenotipo. Este abordaje, usado en el Proyecto Genoma Humano es lento, costoso y, muchas veces, infructuoso.
Actualmente, pueden estudiarse los genes responsables de cada patología o incluso todos los genes de un individuo en un solo experimento de NGS. Esto ha reducido enormemente los costes de secuenciación y ha mejorado los tiempos de respuesta, en comparación con el método Sanger.
En clínica, la NGS se aplica con frecuencia en el diagnóstico de enfermedades genéticas. Este incluye desde trastornos monogénicos como la fibrosis quística, hasta enfermedades con alta heterogeneidad genética.
En las enfermedades heterogéneas, distintas variantes en distintos genes pueden ser las causantes de la enfermedad como en el caso de las cardiopatías hereditarias. La identificación de las mutaciones causantes es fundamental para su diagnóstico, pronóstico y manejo clínico.
Además de variantes puntuales, inserciones y deleciones, la NGS permite la detección de algunas variantes estructurales complejas que eran difíciles de identificar con la secuenciación Sanger. Al mismo tiempo, debido a su elevada sensibilidad, la NGS es capaz de identificar mutaciones presentes en un porcentaje muy pequeño de células (mosaicismos).
Aplicaciones clínicas actuales
- Paneles de genes en diagnóstico de enfermedades hereditarias
En CLILAB Diagnòstics realizamos estudios NGS en pacientes derivados de muchos de estos servicios clínicos, asegurando un seguimiento integral del paciente.
- Diagnóstico del cáncer
Además, los paneles de NGS son útiles en la oncología de precisión. Se basa en la búsqueda de alteraciones genéticas tumorales que sean predictivas de respuesta a un tratamiento.
Así, mediante paneles NGS se analiza el ADN tumoral de cada paciente y, basándose en la detección de biomarcadores moleculares predictivos, se pueden seleccionar los tratamientos más adecuados para cada individuo.
- Diagnóstico de trastornos del neurodesarrollo
La NGS permite un enfoque integral, analizando simultáneamente cientos de genes que se han asociado a estos trastornos. Esto ayuda a confirmar un diagnóstico clínico, identificar nuevas mutaciones que contribuyen al fenotipo del paciente y detectar las CNVs con alta resolución.
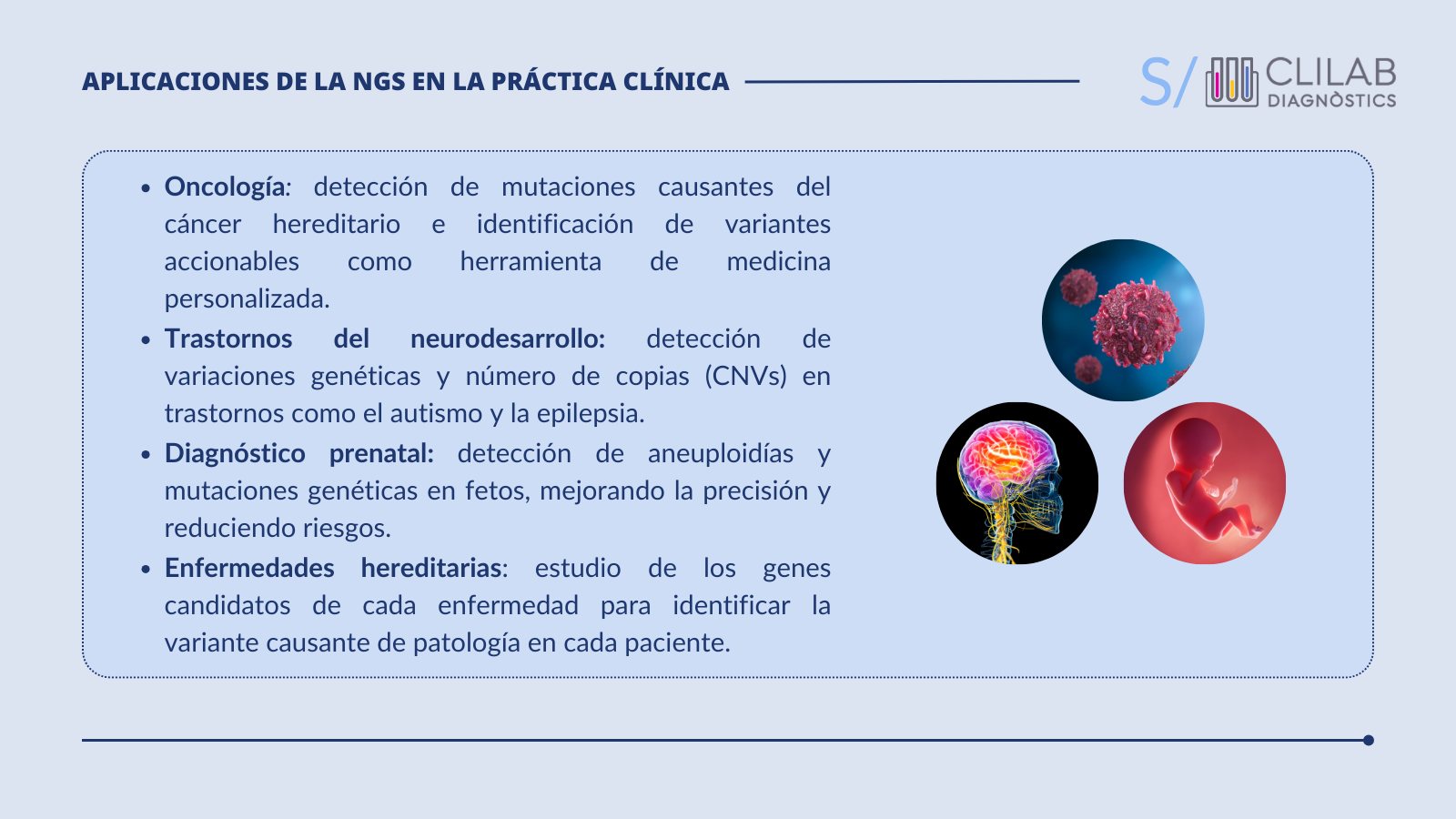
La secuenciación masiva permite analizar tanto el ADN fetal libre circulante (cfDNA) en el plasma materno como células del embrión obtenidas a través de una biopsia.
La NGS ha permitido mejorar la detección de anomalías genéticas y reducir el riesgo asociado a procedimientos invasivos, como la amniocentesis. Esto ha mejorado el manejo de embarazos de alto riesgo, proporcionando a los médicos y familia la información necesaria para poder tomar decisiones informadas.
Desafíos y perspectivas futuras en el diagnóstico clínico
La expansión de la NGS en el diagnóstico clínico dependerá del avance tecnológico y los costos asociados en áreas como:
- Medicina genómica preventiva: la identificación de predisposiciones genéticas podría permitir la implementación de estrategias de prevención personalizadas para enfermedades complejas como el cáncer o las enfermedades cardiovasculares.
- Diagnóstico de enfermedades infecciosas: para su detección y seguimiento en el manejo de las pandemias y las resistencias a los antibióticos, permitiendo una respuesta más rápida y efectiva.
- NGS en la evaluación de los cambios genéticos: tras la aplicación de terapias genéticas y tecnologías de edición genética, como CRISPR, para monitorizar los resultados y detectar posibles efectos secundarios.
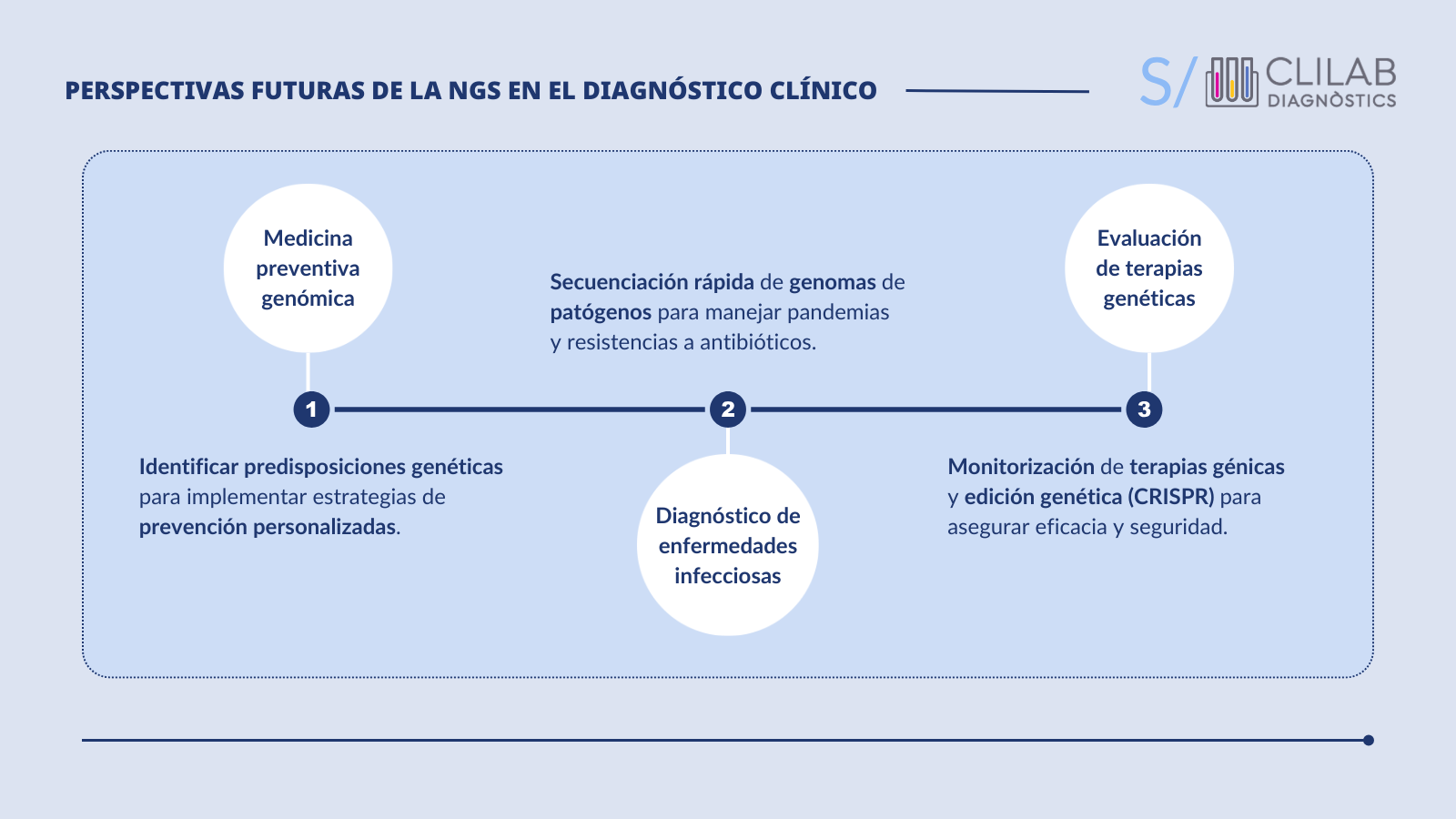
No obstante, los retos que aún enfrenta se centran en mejorar la interpretación de los datos y la clasificación de las variantes inciertas, así como gestionar, analizar e interpretar la gran cantidad de datos generados.
Por ello, ha surgido también la secuenciación de tercera generación, que permite una comprensión más completa de la estructura y función del genoma al leer fragmentos más largos. .
Todas estas innovaciones prometen mejorar la precisión, reducir costos y tiempos de análisis y aumentar la accesibilidad de la tecnología NGS así como mejorar la efectividad y seguridad de la atención médica.
Conclusión
La integración de la NGS, está revolucionando la manera de analizar e interpretar los resultados genéticos individuales. Esto promueve el desarrollo de la medicina de precisión al ofrecer servicios más personalizados.
El avance de la medicina genómica requiere una colaboración estrecha entre clínicos, genetistas y asesores genéticos y de la actualización constante de los profesionales de la salud.
En CLILAB invitamos a los profesionales de la salud a mantenerse actualizados con los últimos avances en NGS y otras tecnologías emergentes. Explora nuestras soluciones y recibe el soporte necesario para integrar estas innovaciones en la práctica clínica.
Artículos relacionados:
Cribado prenatal de alteraciones cromosómicas
Referencias
1.Mandlik JS, Patil AS, Singh S. Next-Generation Sequencing (NGS): Platforms and Applications. Journal of Pharmacy and Bioallied Sciences. 2024;16(Suppl 1):S41-S45. doi:https://doi.org/10.4103/jpbs.jpbs_838_23
2.Satam H, Joshi K, Mangrolia U, et al. Next-Generation Sequencing Technology: Current Trends and Advancements. Biology. 2023;12(7):997. doi:https://doi.org/10.3390/biology12070997
3.Rubio S, Pacheco-Orozco R, Gómez A, Perdomo S, Robles R. Secuenciación de nueva generación (NGS) de ADN: presente y futuro en la práctica clínica. Universitas Médica. 2020;61(2):doi:10.11144/Javeriana.umed61-2.sngs.
