Papel del laboratorio en el cribado y el diagnóstico de la preeclampsia

El manejo clínico de la preeclampsia ha mejorado gracias a los avances en el laboratorio clínico, como el uso de biomarcadores sFlt-1 y PlGF, que junto con modelos predictivos integrados, permiten una detección más precisa y un seguimiento efectivo.
La PE es una de las principales complicaciones del embarazo y afecta a entre el 3 % y el 5 % de las gestantes en todo el mundo. La PE se asocia con una elevada morbilidad y mortalidad de la madre y el feto.
La International Society for the Study of Hypertension in Pregnancy (ISSHP) define la PE como la aparición de hipertensión gestacional acompañada de, al menos, una de las siguientes características:
- Proteinuria: definida por al menos una de las siguientes condiciones:
- Excreción de ≥300 mg de proteínas en orina de 24 horas.
- Cociente de proteínas/creatinina ≥30 mg/mmol en una muestra de orina puntual.
- Si no se dispone de ninguno de estos métodos, es razonablemente válido un resultado de ≥2+ de proteínas en el análisis sistemático de la orina.
- Otras características de disfunción orgánica materna:
- Lesión renal aguda (creatinina ≥1 mg/dl)
- Afectación hepática (concentración de transaminasas elevada)
- Complicaciones neurológicas (por ejemplo, eclampsia, alteraciones del estado mental, ceguera, accidente cerebrovascular, clono, dolor de cabeza intenso o escotoma visual persistente)
- Alteraciones hematológicas (trombocitopenia , coagulación intravascular diseminada o hemólisis).
- Disfunción uteroplacentaria
- Restricción del crecimiento intrauterino
- Alteración en la ecografía Doppler de la arteria umbilical
- Muerte fetal
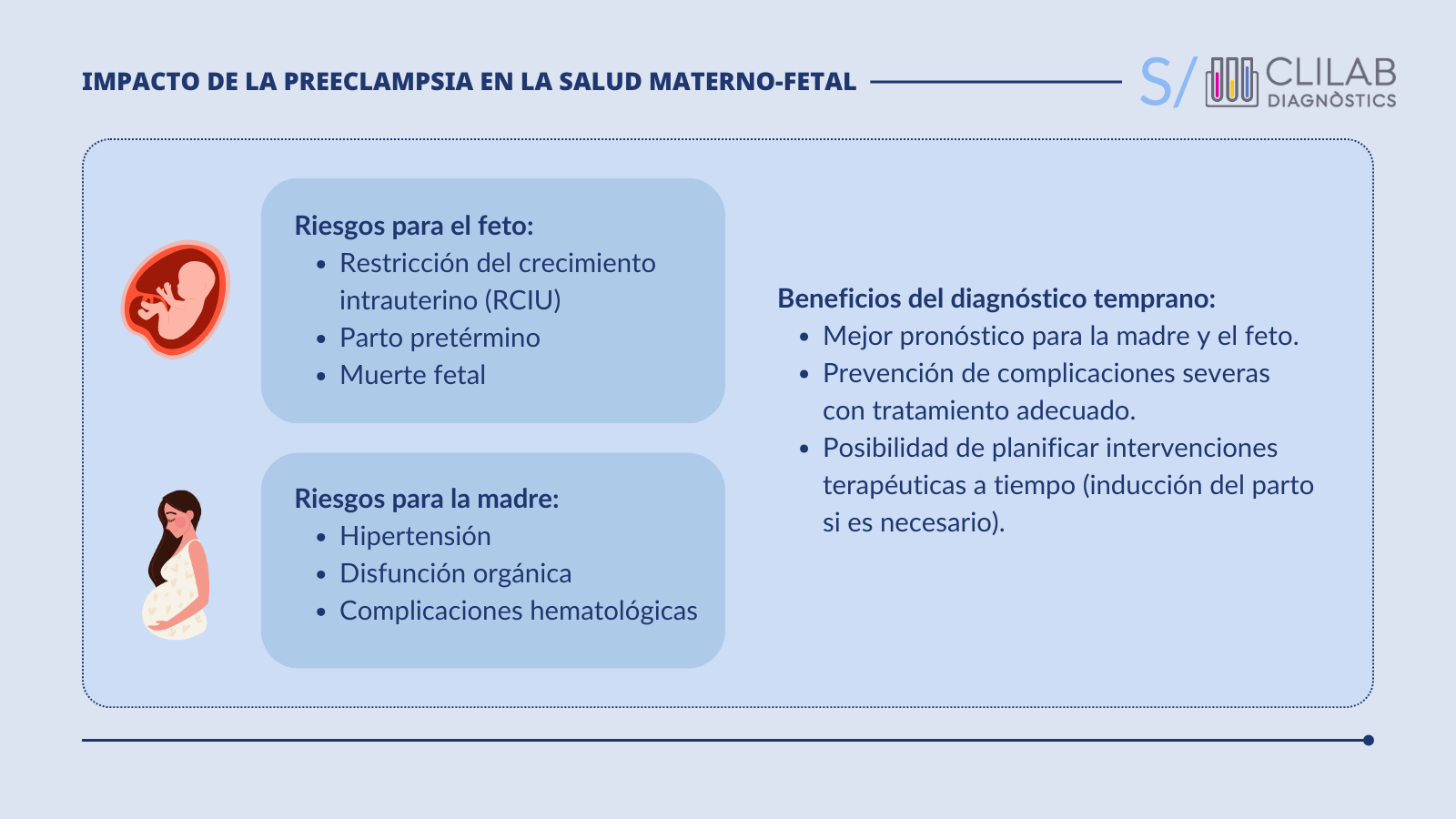
En función de la edad gestacional a la que se presenta, la PE se puede clasificar en precoz (<34 semanas de gestación) y tardía (≥34 semanas de gestación). Además, según el momento en el que se produce el parto, la PE se clasifica en pretérmino (<37 semanas de gestación) y a término (≥37 semanas de gestación).
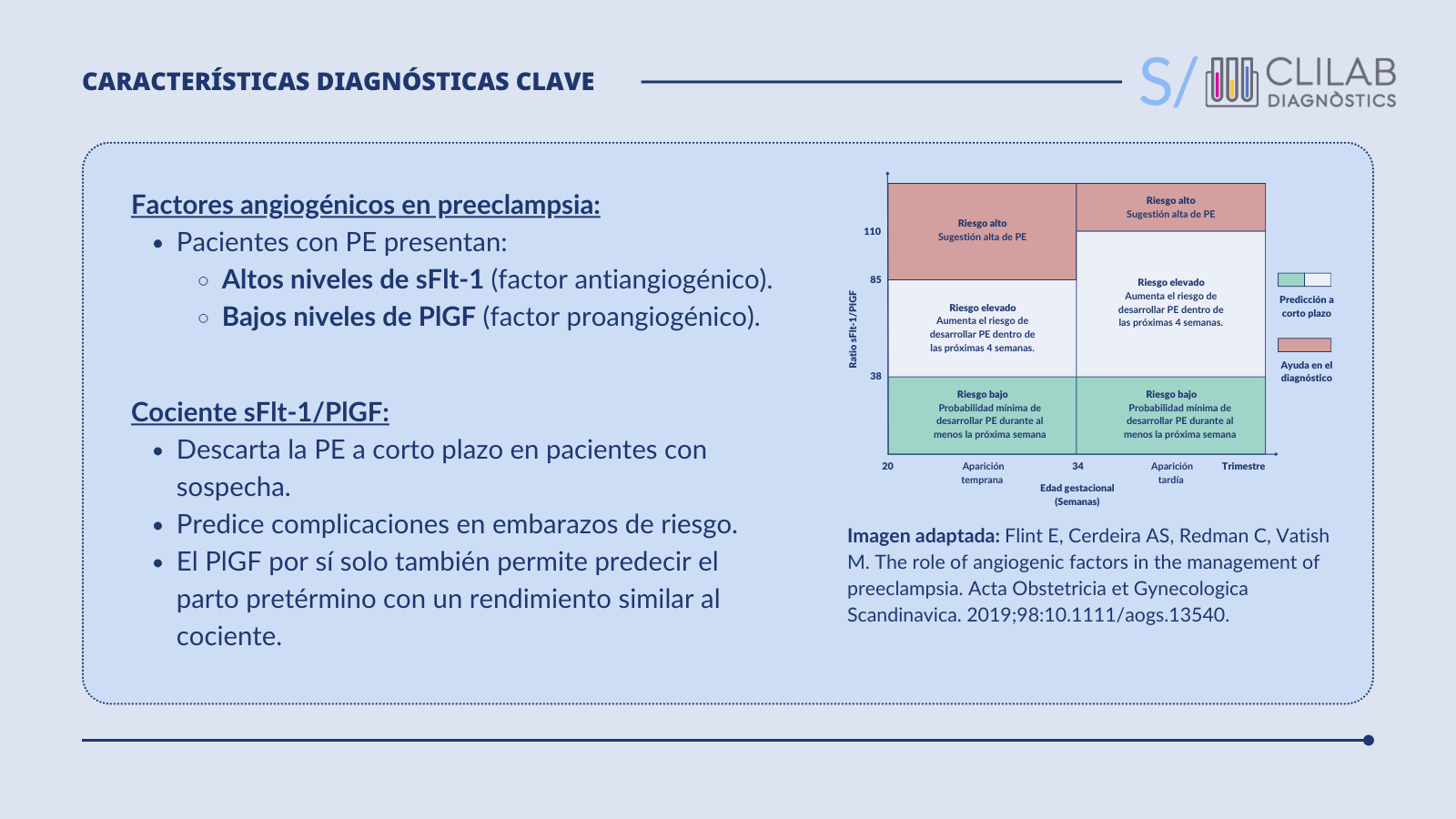
Durante la gestación, la placenta produce proteínas que participan en la regulación de la homeostasis vascular. La producción de estas proteínas está alterada en las pacientes con PE, de modo que tienen concentraciones más elevadas de factores antiangiogénicos y más bajas de factores proangiogénicos en comparación con las gestantes sin PE. La alteración del equilibrio entre los factores anti- y proangiogénicos sienta las bases de la disfunción endotelial característica de la PE.
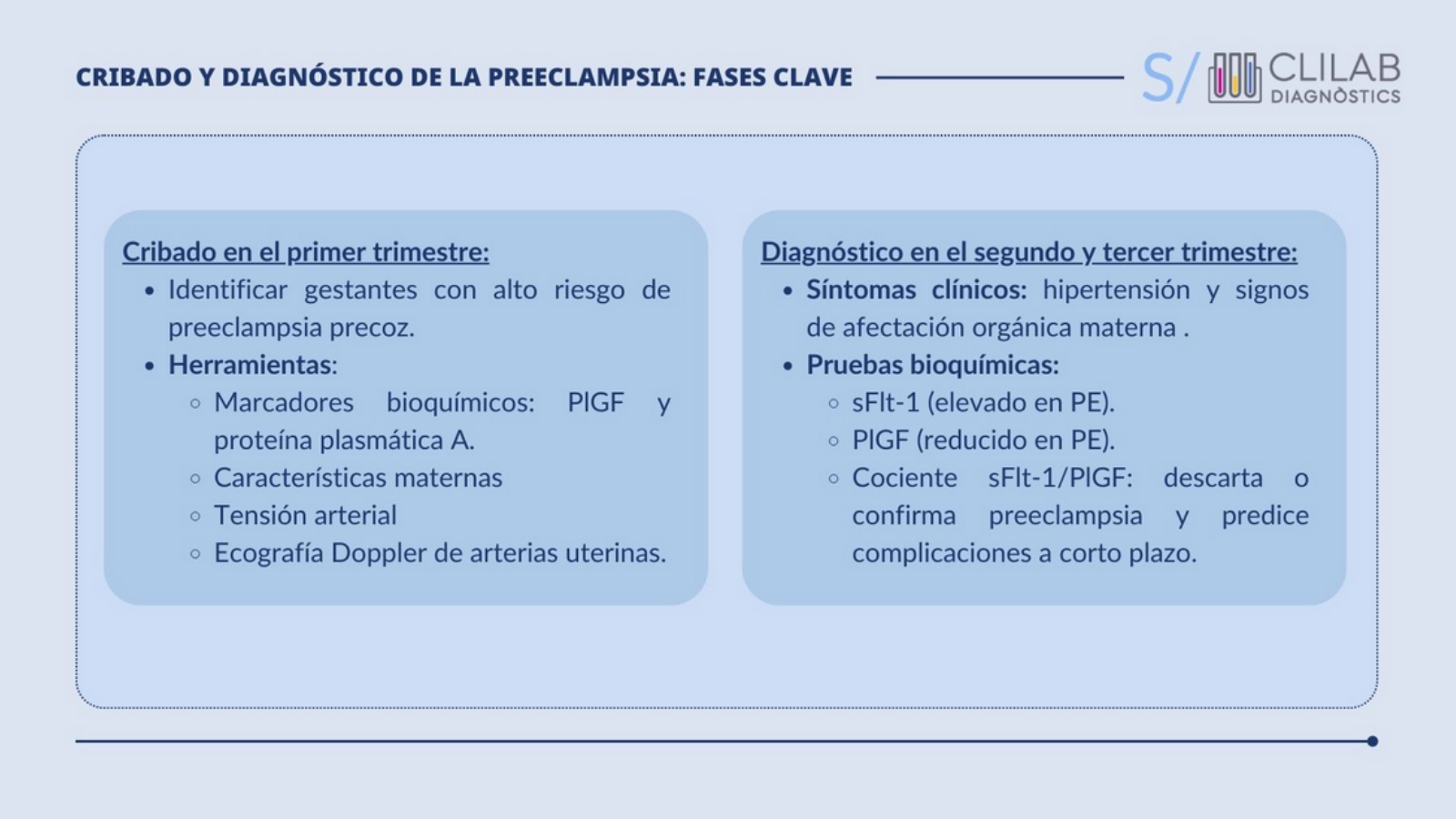
Cribado en el primer trimestre
Disponer de herramientas para estratificar a las gestantes en función del riesgo en el primer trimestre permitiría identificar qué mujeres se beneficiarían de intensificar los controles durante el embarazo o del tratamiento profiláctico con dosis bajas de ácido acetilsalicílico.
Las principales guías clínicas (National Institute for Health and Care Excellence (NICE) y el American College of Obstetricians and Gynecologists) basan la estratificación del riesgo en la presencia de ciertas características en la madre o el feto como:
- Antecedentes de PE
- Insuficiencia renal crónica
- Hipertensión crónica
- Diabetes
- Enfermedades autoinmunes
En los últimos años, se han propuesto algoritmos de cribado de la PE que combinan marcadores bioquímicos junto con características maternas, la tensión arterial y los resultados de la ecografía Doppler.
No obstante, aunque el cribado y la profilaxis con ácido acetilsalicílico en el primer trimestre representan grandes avances para minimizar el impacto de la PE precoz, no son capaces de predecir o prevenir los casos de PE tardía, que son los más frecuentes.
La Sociedad Española de Ginecología y Obstetricia (SEGO) considera que cada centro debe asumir un modelo de cribado adaptado a los medios disponibles y las circunstancias organizativas.
Ante la sospecha clínica de preeclampsia (PE) en mujeres embarazadas durante el segundo trimestre de gestación, en el CLILAB Diagnòstics ofrecemos la posibilidad de solicitar la determinación de los factores anti- y proangiogénicos asociados a este trastorno:
- La forma soluble de la tirosina quinasa de tipo fms 1 (sFlt-1)
- El factor de crecimiento placentario (PlGF)
- El cociente entre ambos (sFlt-1/PlGF)
Exclusión y confirmación del diagnóstico
Los marcadores bioquímicos sFlt-1 y PlGF y el cociente entre ambos son especialmente relevantes para confirmar o descartar la PE a partir del segundo trimestre cuando el diagnóstico no está claro o la presentación clínica es ambigua.
El estudio PROGNOSIS evaluó el rendimiento del cociente sFlt-1/PlGF para confirmar o descartar la PE a corto plazo en gestantes con sospecha de la enfermedad (<37 semanas). Un cociente sFlt-1/PlGF <38 permitió descartar la PE en 1 semana con un valor predictivo negativo (VPN) del 99,3 %. Un análisis posterior mostró que este mismo punto de corte excluía la PE en hasta 4 semanas con un VPN del 94,3 %.
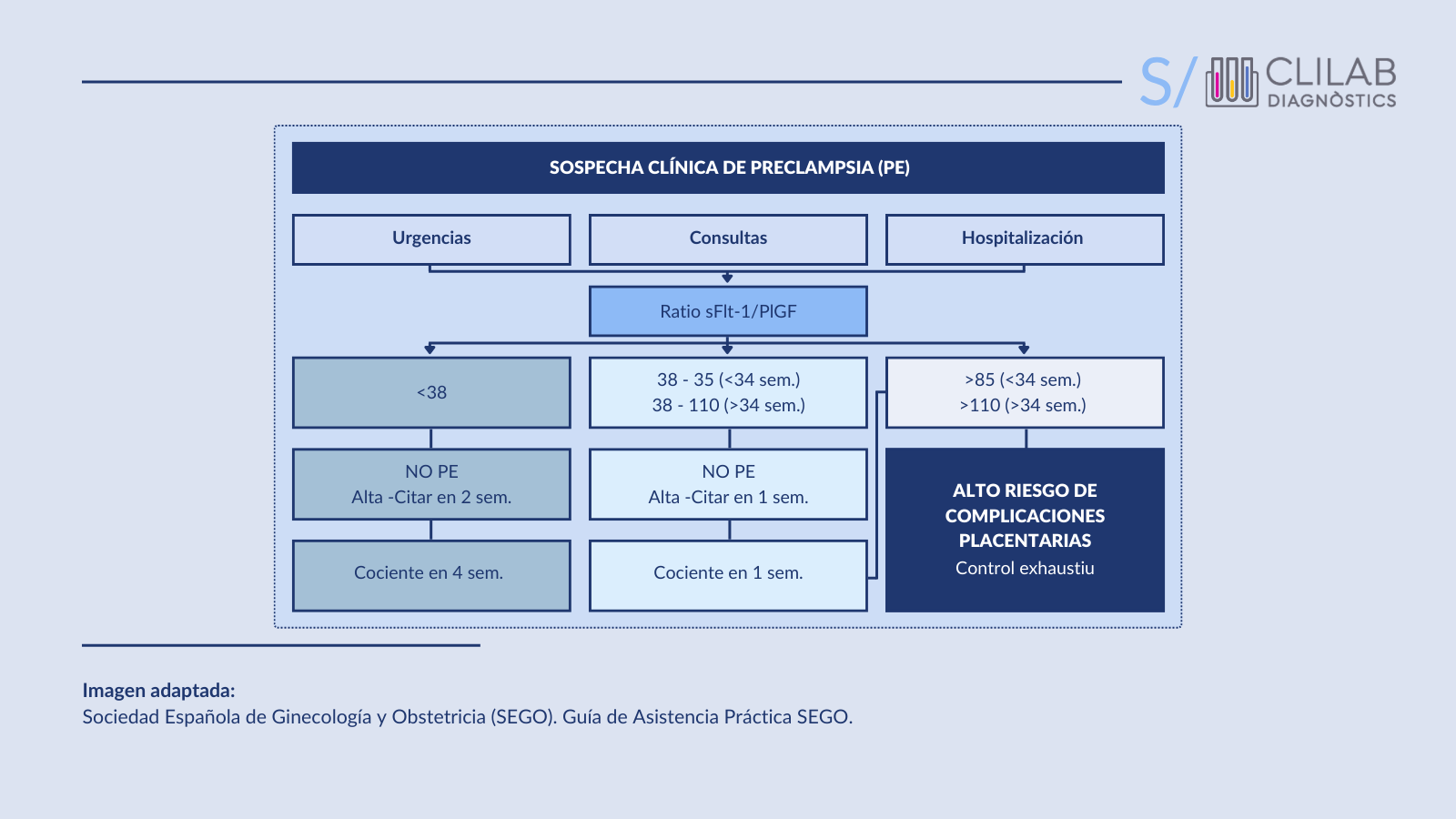
Su implementación puede reducir ingresos hospitalarios y controles innecesarios en mujeres de bajo riesgo. Además, el cociente sFlt-1/PlGF también es útil para ayudar a diagnosticar la PE y predecir el riesgo de complicaciones en pacientes con sospecha de la enfermedad. Aunque no existe un consenso global, en la guía clínica de la SEGO se proponen las siguientes recomendaciones en el uso de los marcadores angiogénicos:
El PlGF aislado también ha mostrado resultados prometedores. El estudio COMPARE concluyó que la capacidad del PlGF para predecir el parto pretérmino en 2 semanas en embarazadas con sospecha era similar a la del cociente sFlt-1/PlGF, con un VPN de entre el 95 % y el 97 %.
Aunque el valor predictivo positivo y la sensibilidad de las diferentes pruebas fue similar, la especificidad del cociente sFlt-1/PlGF fue superior a la del PlGF.
Las guías clínicas del NICE recomiendan tanto el cociente sFlt-1/PlGF como el PlGF junto con la evaluación clínica para descartar o confirmar la PE pretérmino en gestantes con sospecha de la enfermedad.
Al implementar estas pruebas en la práctica clínica, se debe tener en cuenta que el rendimiento y los puntos de corte pueden variar en función del inmunoensayo utilizado. Actualmente, la guía NICE solo recomienda los inmunoensayos Triage PLGF Test (Quidel), Elecsys immunoassay sFlt‑1/PLGF ratio (Roche), DELFIA Xpress PLGF 1‑2‑3 y DELFIA Xpress sFlt-1 kit (PerkinElmer).
Además, se ha observado que la evaluación de urgencia de los marcadores cardíacos en mujeres con preeclampsia es esencial para evaluar la función cardiovascular y el riesgo de complicaciones, así como para guiar el tratamiento adecuado.
En todo caso, cabe destacar que el diagnóstico de la PE sigue siendo clínico y la decisión de finalizar la gestación debe basarse en el cuadro clínico de la paciente.
Conclusiones
En los últimos años, el laboratorio clínico ha adquirido un papel muy relevante en el abordaje de las pacientes con sospecha de PE. El PlGF y el cociente sFlt-1/PlGF son especialmente útiles para descartar la PE a corto plazo, aunque también ayudan a confirmar el diagnóstico y a predecir el riesgo de complicaciones.
Además, los algoritmos que incluyen el PlGF junto con otras variables físicas y ecográficas ofrecen resultados prometedores para el cribado de la PE en el primer trimestre de gestación.
Artículos relacionados:
Bibliografía:
1. Brown MA, Magee LA, Kenny LC, Karumanchi SA, McCarthy FP, Saito S, Hall DR, Warren CE, Adoyi G, Ishaku S, International Society for the Study of Hypertension in Pregnancy (ISSHP). Hypertensive Disorders of Pregnancy: ISSHP Classification, Diagnosis, and Management Recommendations for International Practice. Hypertens Dallas Tex 1979. julio de 2018;72(1):24-43.
2. Phipps EA, Thadhani R, Benzing T, Karumanchi SA. Pre-eclampsia: pathogenesis, novel diagnostics and therapies. Nat Rev Nephrol. mayo de 2019;15(5):275-89.
3. Rana S, Lemoine E, Granger JP, Karumanchi SA. Preeclampsia. Circ Res. 29 de marzo de 2019;124(7):1094-112.
4. Tan MY, Wright D, Syngelaki A, Akolekar R, Cicero S, Janga D, Singh M, Greco E, Wright A, Maclagan K, Poon LC, Nicolaides KH. Comparison of diagnostic accuracy of early screening for pre-eclampsia by NICE guidelines and a method combining maternal factors and biomarkers: results of SPREE. Ultrasound Obstet Gynecol. 2018;51(6):743-50.
5. O’Gorman N, Wright D, Poon LC, Rolnik DL, Syngelaki A, de Alvarado M, Carbone IF, Dutemeyer V, Fiolna M, Frick A, Karagiotis N, Mastrodima S, de Paco Matallana C, Papaioannou G, Pazos A, Plasencia W, Nicolaides KH. Multicenter screening for pre-eclampsia by maternal factors and biomarkers at 11–13 weeks’ gestation: comparison with NICE guidelines and ACOG recommendations. Ultrasound Obstet Gynecol. 2017;49(6):756-60.
6. Scazzocchio E, Crovetto F, Triunfo S, Gratacós E, Figueras F. Validation of a first-trimester screening model for pre-eclampsia in an unselected population. Ultrasound Obstet Gynecol Off J Int Soc Ultrasound Obstet Gynecol. febrero de 2017;49(2):188-93.
7. Zeisler H, Llurba E, Chantraine F, Vatish M, Staff AC, Sennström M, Olovsson M, Brennecke SP, Stepan H, Allegranza D, Dilba P, Schoedl M, Hund M, Verlohren S. Predictive Value of the sFlt-1:PlGF Ratio in Women with Suspected Preeclampsia. N Engl J Med. 7 de enero de 2016;374(1):13-22.
8. Zeisler H, Llurba E, Chantraine FJ, Vatish M, Staff AC, Sennström M, Olovsson M, Brennecke SP, Stepan H, Allegranza D, Schoedl M, Grill S, Hund M, Verlohren S. Soluble fms-like tyrosine kinase-1 to placental growth factor ratio: ruling out pre-eclampsia for up to 4 weeks and value of retesting. Ultrasound Obstet Gynecol Off J Int Soc Ultrasound Obstet Gynecol. marzo de 2019;53(3):367-75.
9. Sociedad Española de Ginecología y Obstetricia. Guía de Asistencia Práctica. Trastornos hipertensivos en la gestación. Prog Obstet Ginecol. 2020;63:244-72.
10. McCarthy FP, Gill C, Seed PT, Bramham K, Chappell LC, Shennan AH. Comparison of three commercially available placental growth factor-based tests in women with suspected preterm pre-eclampsia: the COMPARE study. Ultrasound Obstet Gynecol. 2019;53(1):62-7.
11. Poon LC, Magee LA, Verlohren S, Shennan A, von Dadelszen P, Sheiner E, Hadar E, Visser G, Da Silva Costa F, Kapur A, McAuliffe F, Nazareth A, Tahlak M, Kihara AB, Divakar H, McIntyre HD, Berghella V, Yang H, Romero R, Nicolaides KH, Melamed N, Hod M. A literature review and best practice advice for second and third trimester risk stratification, monitoring, and management of pre-eclampsia. Int J Gynecol Obstet. 2021;154(S1):3-31.
12. MacDonald TM, Walker SP, Hannan NJ, Tong S, Kaitu’u-Lino TJ. Clinical tools and biomarkers to predict preeclampsia. eBioMedicine 2022 Jan;75:103780.
13. NICE guideline. Hypertension in pregnancy: diagnosis and management [Internet]. Londres (Reino Unido): NICE; 25 jun 2019 [citado 9 ene 2023]. 57 p. Disponible en: https://www.nice.org.uk/guidance/ng133
14. American College of Obstetricians and Gynecologists. Gestational Hypertension and Preeclampsia: ACOG Practice Bulletin, Number 222. Obstet Gynecol. junio de 2020;135(6):e237.
15. Chappell LC, Duckworth S, Seed PT, Griffin M, Myers J, Mackillop L, Simpson N, Waugh J, Anumba D, Kenny LC, Redman CWG, Shennan AH. Diagnostic accuracy of placental growth factor in women with suspected preeclampsia: a prospective multicenter study. Circulation. 5 de noviembre de 2013;128(19):2121-31.
16. Duhig KE, Myers J, Seed PT, Sparkes J, Lowe J, Hunter RM, Shennan AH, Chappell LC, Bahl R, Bambridge G, Barnfield S, Ficquet J, Gill C, Girling J, Harding K, Khalil A, Sharp A, Simpson N, Tuffnell D. Placental growth factor testing to assess women with suspected pre-eclampsia: a multicentre, pragmatic, stepped-wedge cluster-randomised controlled trial. The Lancet. 4 de mayo de 2019;393(10183):1807-18.
17. NICE. Diagnostics guidance. PLGF-based testing to help diagnose suspected preterm pre-eclampsia [Internet]. Londres (Reino Unido): NICE; 27 jul 2022 [citado 11 ene 2023]. 27 p. Disponible en: https://www.nice.org.uk/guidance/dg49/chapter/1-Recommendations
18.GUÍA de ASISTENCIA PRÁCTICA SEGO. Accessed September 23, 2024. https://bibliotecavirtual.sego.es/uploads/app/1297/elements/file/file1677840183.pdf
19. Rodríguez E, Monsalud M, Ramírez A. MARCADORES CARDIACOS EN PROCESOS ISQUÉMICOS.; 2014. Accessed September 23, 2024. https://www.seqc.es/download/tema/3/2763/94944894/719486/cms/tema-3-biomarcadores-cardiacos-en-procesos-isquemicos.pdf/
